

Patiënten met spinale musculaire atrofie (SMA) type 1 die werden behandeld met risdiplam, lieten gunstige resultaten zien ten aanzien van de werkzaamheid en veiligheid na een follow-up van 36 maanden. Tijdens EAN presenteerde prof. Nicolas Deconinck (UZ Gent, België) follow-up gegevens van de open-label extensie van de FIREFISH-studie na 36 maanden behandeling met risdiplam.
Risdiplam is een pre-mRNA-splitsingsmodificator van survival motor neuron 2 (SMN2). Bij spinale musculaire atrofie (SMA) leidt dit geneesmiddel tot verhoging en behoud van de hoeveelheid functioneel SMN-eiwit, dat rechtstreeks is gerelateerd aan de pathofysiologie van SMA met onder meer toenemend verlies van motorneuronen en spierzwakte. Risdiplam is goedgekeurd door de Europese Commissie voor de behandeling van patiënten van ≥2 maanden met een klinische diagnose van SMA type 1, 2 of 3 of met 1-4 SMN2-kopieën. In de FIREFISH-studie werd de werkzaamheid en het bijwerkingenprofiel van risdiplam onderzocht bij kinderen met SMA type 1 en twee SMN2-genkopieën. Voor deze kinderen is volgens het natuurlijke beloop de mediane leeftijd (IQR) tot overlijden of permanente beademing 10,5 (8,1-13,6) maanden. In de analyse van de FIREFISH-studie kon na 24 maanden behandeling met risdiplam de mediane tijd tot overlijden of permanente beademing niet worden geschat vanwege te weinig events. Tijdens EAN 2022 werden aanvullende gegevens over de werkzaamheid en bijwerkingen gepresenteerd van de FIREFISH open-label-extensie van patiënten na 36 maanden behandeling met risdiplam.
FIREFISH is een multicenter, open-label, tweedelige klinische studie van risdiplam bij kinderen met SMA type 1 en twee SMN2-genkopieën (inclusiecriteria 1-7 maanden oud bij inclusie). Deel 1 (n=21) beoordeelde de veiligheid, verdraagbaarheid en farmacokinetiek/farmacodynamiek van verschillende risdiplam-doseringen. Deel 2 (n=41) beoordeelde het bijwerkingenprofiel en de werkzaamheid van risdiplam bij de na deel 1 geselecteerde dosering.
De open-label extensie bevat 52 patiënten van wie 46 met een follow-up van 36 maanden. Tot de cutoff-datum (23 november 2021) was de mediane blootstellingsduur aan risdiplam 39,5 maanden (bereik: 1,6 – 50,4 maanden). In delen 1 en 2 van de FIREFISH-studie was zitten zonder ondersteuning vastgesteld als primaire doelstelling. Zonder behandeling zijn kinderen met SMA type 1 nooit in staat om zonder ondersteuning te zitten. Kinderen die met risdiplam werden behandeld, bleven na 36 maanden in staat om zonder steun rechtop te zitten of verbeterden verder. 32 patiënten behielden hun vermogen en 4 patiënten waren voor het eerst in staat om 5 seconden lang zonder steun rechtop te zitten. 20 patiënten behielden hun vermogen en 15 patiënten waren voor het eerst in staat om gedurende 30 seconden zonder steun rechtop te zitten. Ook de CHOP-INTEND totaalscore bleef verbeteren van maand 24 naar maand 36. In totaal bereikten 36/46 (78%) patiënten na 36 maanden een CHOP-INTEND score van ≥40. Bij een natuurlijk beloop van SMA type 1 bereiken kinderen slechts zelden een totaalscore van 40 punten. Kinderen behielden of bleven HINE-22 motorische mijlpalen bereiken van maand 24 naar maand 36. Zo ontwikkelden 5 kinderen het vermogen om zonder steun te staan. Een meerderheid van de kinderen bleef na 36 maanden in staat om te slikken en orale voeding te nemen. Het aantal ziekenhuisopnames daalde in de loop van de tijd bij kinderen die met risdiplam werden behandeld. Na 36 maanden behandeling met risdiplam was de eventvrije overleving sterk verbeterd ten opzichte van het natuurlijk beloop. 84% van de behandelde kinderen was eventvrij na 36 maanden, terwijl 91% nog in leven was. In de periode van 2 jaar tussen de cutoff-data van de primaire analyse en deze analyse deden zich geen nieuwe sterfgevallen voor. Het aantal bijwerkingen en ernstige bijwerkingen was na 36 maanden afgenomen bij kinderen die werden behandeld met risdiplam (zie Figuur 1). De meest voorkomende bijwerkingen waren pyrexie (60%), infectie van de bovenste luchtwegen (57%) en pneumonie (43%).
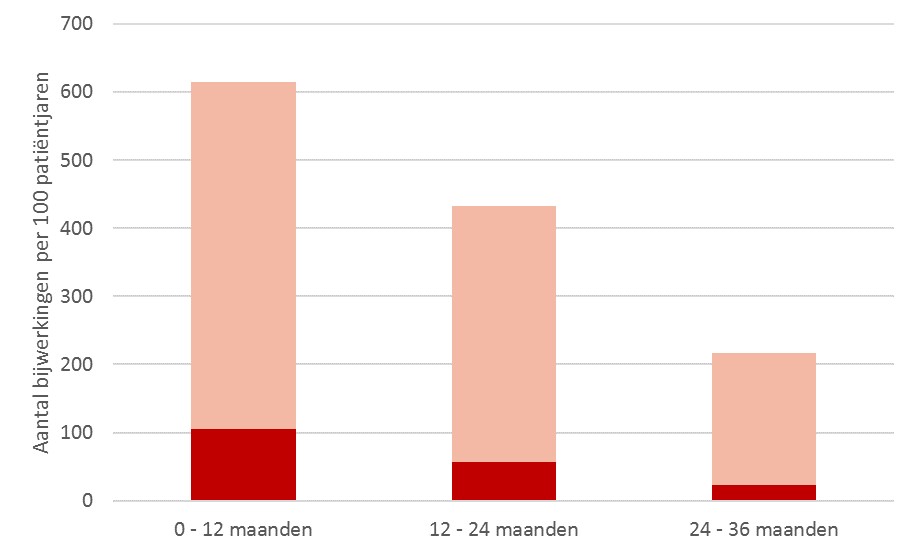
Na een follow-up van 36 maanden behielden of verbeterden kinderen met SMA type 1 die behandeld werden met risdiplam, hun vermogen om zonder steun rechtop te zitten. Ook bleven zij motorische mijlpalen bereiken en bleven verbeteringen van de motorische functie behouden tussen maand 24 en 36. Van alle behandelde kinderen was 91% na 36 maanden nog in leven. Het aantal ernstige bijwerkingen bleef in de loop van de tijd dalen en er waren geen behandelingsgerelateerde bijwerkingen, die leidden tot terugtrekking of stopzetting van de behandeling.
Referentie
Deconinck H, et al. FIREFISH Parts 1 and 2: 36 months safety and efficacy of risdiplam in Type 1 spinal muscular atrophy. Gepresenteerd tijdens EAN 2022; abstract EPR-155