

In de LEARN-studie werden mensen geïncludeerd met preklinische alzheimer die klinisch normaal waren en amyloïd-negatief waren op een PET-scan. De uitkomsten van deze deelnemers werden vergeleken met de uitkomsten van zusterstudie A4 waarin mensen met verhoogde amyloïdwaarden werden geïncludeerd. Aan de hand van de LEARN-studie werd onderzocht wat de impact van deze baseline-amyloïdwaarden was op de longitudinale uitkomsten op gebied van onder meer cognitie en ziekteprogressie. Hierbij werden grote verschillen gezien in de uitkomsten van mensen met lage of hoge amyloïdwaarden.
In de Anti-Amyloid Treatment in Asymptomatic Alzheimer disease (A4)-studie werd onderzoek gedaan naar de mogelijkheid tot het vertragen van progressie bij mensen met preklinische alzheimer, die nog geen cognitieve achteruitgang hadden. De A4-deelnemers vertoonden verhoogde amyloïdniveaus op een PET-scan. Participanten werden 1:1 gerandomiseerd naar behandeling met het anti-amyloïd antilichaam solanezumab of met een placebo. Driekwart (n=3.163) van de mensen met preklinische alzheimer waarvan de amyloïdwaarden werd bepaald, vertoonde echter geen verhoogd amyloïdniveau. Hiervan werd een deel geïncludeerd (n=541) in de Longitudinal Evaluation of Amyloid Risk and Neurodegeneration (LEARN)-studie. Zo konden de uitkomsten en eigenschappen van mensen met preklinische alzheimer met verhoogde amyloïdniveaus worden vergeleken met mensen met preklinische alzheimer zonder verhoogde amyloïdniveaus.
De LEARN-deelnemers moesten aan dezelfde inclusiecriteria voldoen als A4-deelnemers, met uitzondering van de verhoogde amyloïdwaarden. De LEARN-participanten ondergingen ook dezelfde cognitieve en functionele beoordelingen, namelijk elke 6 maanden een preclinical Alzheimer Cognitive Composite (PACC)-beoordeling en elke 12 maanden een beoordeling van de cognitieve functie-index (CFI), dagelijkse activiteiten en klinische dementiescore gedurende 240 weken.
LEARN-deelnemers waren gemiddeld jonger dan A4-deelnemers (respectievelijk gemiddeld 70,5 jaar versus 72 jaar, p<0,001). Daarnaast was het percentage deelnemers met een familiegeschiedenis van dementie (p<0,001) lager binnen LEARN. In totaal had 66,0% van de LEARN-deelnemers een ouder of broer/zus met dementie, tegenover 72,9% van de A4-deelnemers die solanezumab ontving en 77,0% van de A4-deelnemers die een placebo ontving. Verder waren er significante verschillen wat betreft genetica tussen deelnemers uit LEARN en A4. Zo droeg 23% van de LEARN-deelnemers het APOE- ε4-gen tegenover 59% van de A4-deelnemers (p<0,001). Tot slot scoorden de LEARN-deelnemers bij de aanvang van de studie beter op cognitie en fysiek functioneren dan A4-deelnemers. Ze scoorden significant hoger op PACC, uitgestelde reproductie logisch geheugen, mini-mentale staat-onderzoek, gecombineerde CFI-score en ADL-partnerscore. Er werd geen verschil gezien wat betreft de ‘sum of boxes’ klinische dementiescore (‘clinical dementia rating’, CDR-SB).
Gedurende de 4,5-jaar durende onderzoeksperiode werd geen significante afname in de PACC-score gezien bij deelnemers van de LEARN-studie. Bij de start van de studie nam de PACC-score juist toe bij LEARN-deelnemers en aan het einde van de studie scoorden zij op een vergelijkbaar niveau als bij de start van de studie (zie Figuur 1). Wel werd over de tijd een afname in de PACC-score gezien bij deelnemers van de A4-studie, zowel wanneer zij solanezumab als placebo ontvingen (p<0,001 vergeleken met LEARN). Na 240 weken was de PACC-score met -1,43 afgenomen in de solanezumab-arm en met -1,13 in de placebo-arm (verschil: -0,30; p=0,26).
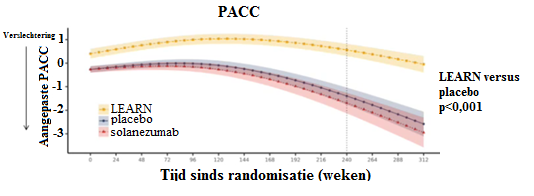
Vergelijkbaar werd gezien dat de amyloïd-negatieve LEARN-deelnemers een kleinere afname vertoonden in CFI, in vergelijking met de A4-deelnemers. Ditzelfde effect was zichtbaar op de dagelijkse activiteiten; deze verslechterden sterk bij deelnemers in de A4-studie, maar veel minder bij LEARN-deelnemers. Ook op het gebied van CDR-SB werd bij LEARN-patiënten slechts een kleine afname gedurende de studiejaren geobserveerd, tegenover een grote afname bij A4-deelnemers. Bij een deel van de LEARN-deelnemers werd een progressiesnelheid tot 0,5 gezien (gemeten met CDR-GS), maar deze ziekteprogressie was op groepsniveau substantieel lager dan bij de A4-deelnemers.
Vervolgens werd nog specifieker bekeken wat de impact van de hoogte van de amyloïdwaarden bij baseline was op de verschillende uitkomsten over de tijd. Daartoe werden de A4-deelnemers onderverdeeld tussen het laagste amyloïdtertiel (<46,1 centiloids), middelste amyloïdtertiel (46,1-77,2 centiloids) en hoogste amyloïdtertiel (>77,2 centiloids). Deze groepen werden vergeleken met de amyloïd-negatieve deelnemers uit LEARN. Uit de analyse bleek dat zowel de amyloïd-negatieve LEARN-deelnemers als de A4-deelnemers uit het laagste amyloïdtertiel weinig verslechtering in PACC vertoonden gedurende de bestudeerde periode. Mensen uit het middelste en hoogste amyloïdtertiel vertoonden een grotere verslechtering op PACC over de tijd, waarbij de grootste cognitie-afname werd gezien bij mensen in het hoogste amyloïdtertiel.
Ditzelfde patroon was ook zichtbaar bij de CFI-uitkomsten en dagelijkse activiteiten, waarbij de kleinste afname in cognitief functioneren werd gezien bij mensen met amyloïd-negativiteit of uit het laagste amyloïdtertiel, met enige overlap tussen deze twee groepen in de eerste vier jaar. Deelnemers uit het middelste en hoogste tertiel vertoonden de grootste afname in cognitief functioneren over de gevolgde periode. Hetzelfde effect werd op de dagelijkse activiteiten en de CBR-progressie geobserveerd.
In de LEARN-studie werden mensen met preklinische alzheimer geïncludeerd die geen verminderde cognitie hadden en amyloïd-negatief waren. De uitkomsten van deze deelnemers werden vergeleken met amyloïd-positieve deelnemers uit de A4-studie. Hierbij werd gezien dat de baseline PET-amyloïdwaardes sterk geassocieerd waren met de snelheid van cognitieve verslechtering en het risico op ziekteprogressie. Ook tussen amyloïd-positieve mensen werden verschillen gezien, waarbij de grootste verslechtering in uitkomsten werd gezien bij de hoogste amyloïdwaarden. Deze bevindingen ondersteunen de hypothese dat het verlagen van de amyloïdniveaus in de preklinische fase van alzheimer belangrijk is om de progressie hiervan te kunnen vertragen.
Referentie
Sperling RA, et al. Anti-Amyloid treatment in Asymptomatic Alzheimer’s disease (A4) and Longitudinal Evaluation of Amyloid Risk and Neurodegeneration (LEARN) Study Longitudinal Results. Gepresenteerd tijdens AAIC 2023;abstract 2-22.