Natalizumab (NTZ) is een hoog-effectieve ziektemodulerende therapie (‘disease-modifying therapy’, DMT) die wordt ingezet als monotherapie bij zeer actieve relapsing-remitting multiple sclerose (RRMS) en snel ontwikkelende RRMS.1 In de klinische praktijk blijkt het gebruik van NTZ op de lange termijn gelimiteerd, door potentiële schadelijke bijwerkingen zoals progressieve multifocale leuko-encefalopathie (PML).2 Dit kan worden voorkomen door gedurende de behandelingsperiode te switchen naar een andere DMT. Dit is echter niet zonder risico; het is mogelijk dat de ziekte weer oplaait en relapsen en/of nieuwe laesies ontstaan. Eerder is al onderzoek gedaan naar het effect van wisselen van DMT bij MS-patiënten met een hoog risico op PML, een consensus is hierbij echter nog niet bereikt. Om deze reden onderzochten dr. Hersch et al. de ‘real-world’-ervaringen met het wisselen van NTZ naar een andere DMT.
In het onderzoek werd het effect bekeken van het wisselen van NTZ naar een gemiddeld-effectieve (‘moderate’, Mod) DMT in vergelijking met een hoog-effectieve therapie (‘high-efficacy therapy’, HET) bij 556 Amerikaanse MS-patiënten. Onder Mod DMT vielen fingolimod (n=140) of dimethylfumaraat (n=130) en opties voor HET waren ocrelizumab, rituximab (n=17) en alemtuzumab (n=7). De meerderheid van deelnemende patiënten beëindigde de behandeling met NTZ wegens een verhoogd risico op het ontwikkelen van PML (n=305, 54,9%). Andere redenen waren het doorbreken van de ziekte (15,3%) en intolerantie tegen het geneesmiddel (17,3%).
Data van de patiënten werd verkregen uit de elektronische medische geschiedenis, hierbij werden ziektekenmerken bekeken van 6 en 12 maanden voor NTZ-behandeling en 6 en 24 maanden na wisselen naar Mod DMT of HET. De effectiviteit van de medicatieswitch werd bepaald aan de hand van inflammatie-uitkomsten zoals het aantal relapsen, MRI-activiteit en de afwezigheid van ziekteactiviteit binnen 6 maanden van de switch.
Uit de analyse bleek binnen 6 maanden geen significant verschil zichtbaar in het aantal klinische relapsen dat patiënten doormaakten wanneer zij werden switchten naar een Mod DMT in vergelijking met HET. Bij patiënten behandeld met Mod DMT maakte 11,7% een klinische relaps door binnen 6 maanden na de switch en bij HET was dit het geval bij 8,7% (odds ratio [OR] aangepast voor ‘propropensity score’: 1,36 [95%-BI: 0,75-1,66]; p=0,72). In de ‘intention-to-treat’-populatie (ITT) werd geen statistisch verschil gezien tussen Mod DMT en HET wat betreft MRI-ziekteactiviteit (OR: 1,68; p=0,07). Dit verschil werd wel gezien als alleen de patiënten mee werden genomen die ook echt de medicatie gebruikten; hierbij bleek dat patiënten die switchten naar een Mod DMT, meer MRI-ziekteactiviteit vertoonden dan patiënten die switchten naar een HET (OR: 2,59; 95%-BI: 1,09-3,87; p=0,04). Ook werden bij Mod DMT-behandelde patiënten meer GdE-laesies gezien (OR: 3,37; 95%-BI: 1,45-4,68; p=0,007) en meer nieuwe T2-hyperintense laesies (OR: 2,18; 95%-CI: 1,10-4,01; p=0,029) dan bij HET. Daarnaast werd er ook minder vaak afwezigheid van ziekteactiviteit gezien bij patiënten geswitcht naar Mod DMT (61,3%) dan bij switches naar HET (80,7%; OR: 0,42; 95%-BI: 0,23-0,76; p=0,004).
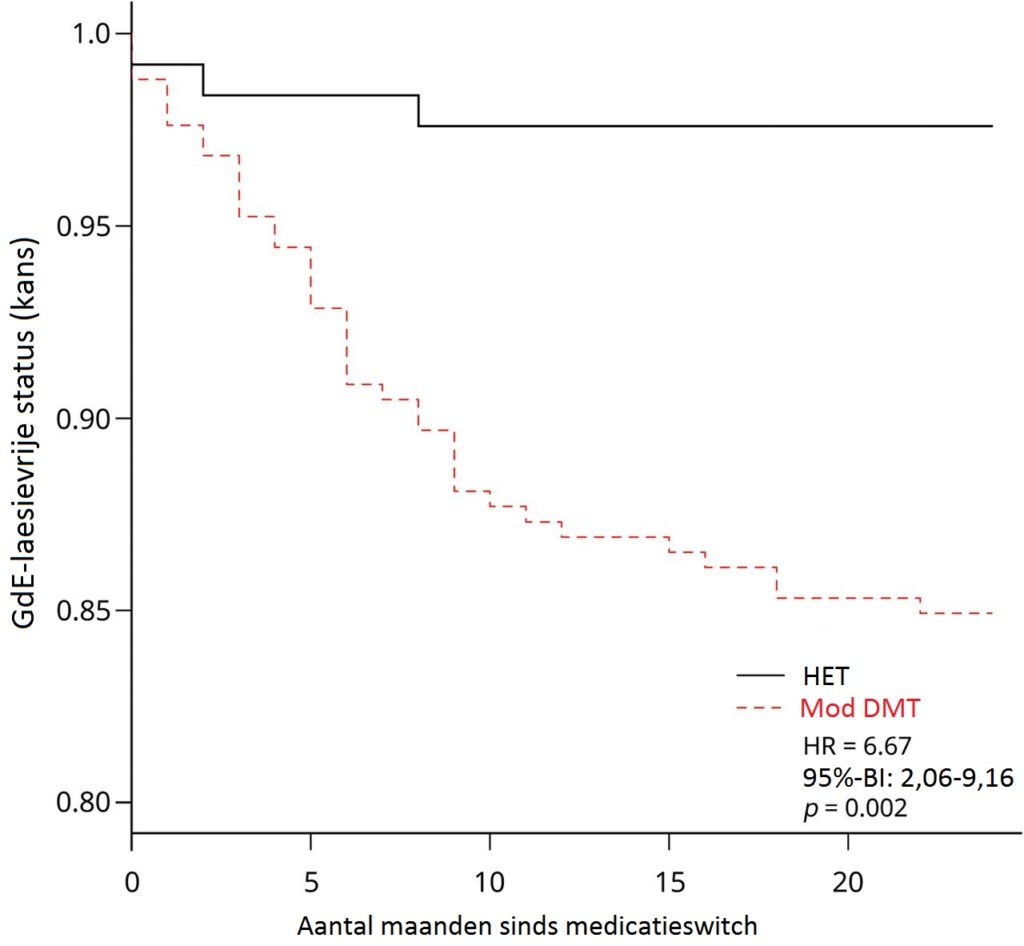
De uitkomsten van de patiënten op 24 maanden na het wisselen van medicatie werden ook geanalyseerd door de onderzoekers. Hierbij werd geen significant verschil gezien in het aantal klinische relapsen of de tijd tot het ontstaan van de eerste relaps. Er werden wel significante verschillen gezien wat betreft MRI-ziekteactiviteit tussen de twee groepen. Na 24 maanden vertoonde 25,4% van de patiënten in de Mod DMT-arm (n=252) MRI-ziekteactiviteit, in vergelijking met 11,9% in de HET-arm (OR: 2,43; 95%-CI: 1,08-3,93; p=0,039) binnen de ITT-populatie. Zo hadden Mod DMT-behandelde MS-patiënten een grotere kans om GdE-laesies te ontwikkelen (OR: 1,99; 95%-BI: 1,12-2,73; p=0,022) en nieuwe T2-hyperintense laesies (OR: 2,15; 95%-BI: 1,18-3,01; p=0,011). Bovendien was de tijd tot het ontwikkelen van een GdE-laesie korter in de Mod DMT-arm (HR: 6,67; 95%-BI: 2,06-9,16; p=0,0020). In de gevoeligheidsanalyse met alleen patiënten die echt met de medicatie werden behandeld, werden vergelijkbare resultaten gezien.
CONCLUSIE
Bij RRMS-patiënten die natalizumab gebruiken, schakelt een deel over naar een andere therapie, vaak wegens een vergroot risico op progressieve multifocale leuko-encefalopathie. In de keuze voor een vervangende behandeling kan onder meer worden gekozen uit een gemiddeld-effectieve DMT als fingolimod of dimethylfumaraat, of een hoog-effectieve therapie als ocrelizumab, rituximab en alemtuzumab. Uit deze ‘real-world’-data met 556 MS-patiënten blijkt dat er geen verschil is in het aantal klinische relapsen dat een patiënt doormaakt binnen 6 of 24 maanden, wanneer wordt gekozen voor een Mod DMT in vergelijking met een HET. Wel wordt meer MRI-ziekteactiviteit gezien bij patiënten die natalizumab inwisselden voor een Mod DMT ten op zichte van een HET. Dit was ook zichtbaar in een hoger aantal GdE-laesies en nieuwe T2-hyperintense laesies. Deze ziekteactiviteit bleef echter wel bij beide behandelgroepen lager dan in de 12 maanden voor NTZ-behandeling en de patiënten maakten dan ook geen ‘rebound’ ziekte mee. De onderzoekers geven aan dat hierbij een kortere uitwasperiode belangrijk was, korter dan 3 maanden. Momenteel wordt een grotere, multicenter studie gepland waarbij de korte- en langetermijneffecten van DMT-gebruik na NTZ verder zullen worden onderzocht.
Referenties