

Het celoppervlakte-eiwit CD20 is inmiddels een bekend en succesvol target voor MS-behandelingen. In de ULTIMATE fase III-studies werd het anti-CD20 antilichaam ublituximab vergeleken met teriflunomide bij patiënten met relapsing-remitting MS. Dr. Lawrence Steinman (Stanford University, Verenigde Staten) presenteerde de resultaten van de 96 weken durende studie op ECTRIMS 2021. Ublituximab werd over het algemeen goed verdragen en resulteerde vergeleken met teriflunomide in een lagere relapsfrequentie, minder laesies en meer verbetering in invaliditeit.
Ublituximab is een anti-CD20 monoklonaal antilichaam. In vergelijking met andere anti-CD20 antilichamen zoals rituximab, ocrelizumab en ofatumumab, is ublituximab ontworpen met behulp van ‘glyco-engineering’ om te zorgen voor een sterkere antilichaam-afhankelijke cellulaire cytotoxiciteit, waardoor lagere doses en kortere infusietijden nodig zijn. ULTIMATE I en II zijn identieke gerandomiseerde dubbelblinde fase III-studies waarin de werkzaamheid en het bijwerkingenprofiel van ublituximab in vergelijking met teriflunomide worden onderzocht bij patiënten met relapsing-remitting MS. Het primaire eindpunt van de studie was de relapsfrequentie na 96 weken.
In ULTIMATE I werden 549 patiënten 1:1 gerandomiseerd en in ULTIMATE II waren dit 545 patiënten. Ublituximab (450 mg) werd via een 1 uur durende infusie elke 24 weken toegediend na een startdosis van 150 mg op dag 1. De patiëntkenmerken bij aanvang van de studie waren goed in balans en in alle armen van de studies doorliep circa 90% de gehele studieperiode van 96 weken.
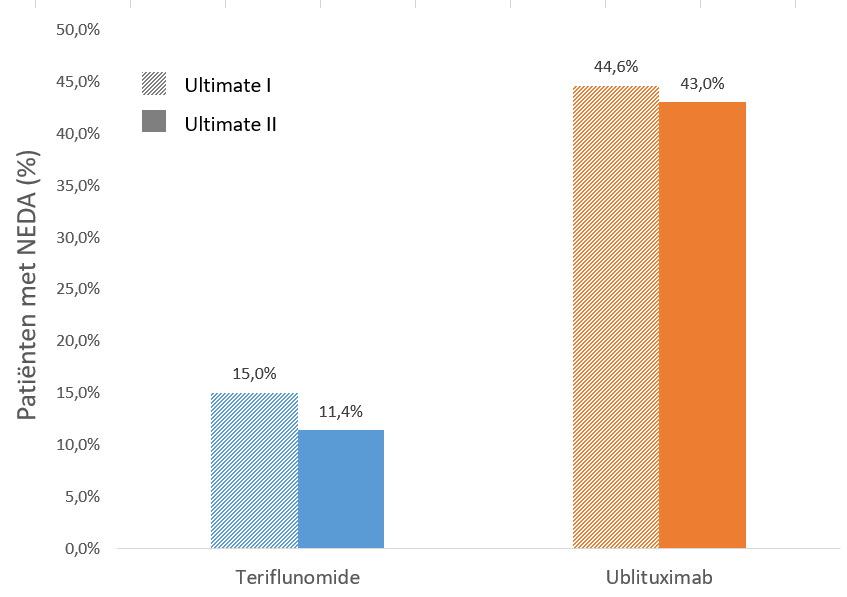
In beide studies werd het primaire eindpunt behaald. De relapsfrequentie in ULTIMATE I en II was respectievelijk 0,188 en 0,178 per jaar met teriflunomide en 0,076 en 0,091 per jaar met ublituximab. Dit kwam overeen met een verschil van respectievelijk 59% (p<0,0001) en 49% (p=0,0022) voor de twee studies. Ublituximab deed het ook beter dan teriflunomide bij verschillende secundaire eindpunten. Zowel het aantal gadoliniumaankleurende T1-laesies als het aantal nieuwe of vergrote T2-laesies was in beide studies meer dan 90% lager met ublituximab. In ULTIMATE I bereikte 15,0% van de patiënten met teriflunomide NEDA (‘no evidence of disease activity’), tegenover 44,6% met ublituximab (oddsratio [OR]: 5,44; 95%-BI: 3,54-8,38). In ULTIMATE II waren deze verschillen vergelijkbaar groot met respectievelijk 11,4% en 43,0% (OR: 7,95; 95%-BI: 4,92-12,84).
De ‘multiple sclerosis functional composite’ (MSFC) is een schaal die dimensies kent voor beenfuncties, armfuncties en cognitie. Binnen ULTIMATE I werd een toename van de MSFC-score gezien van 0,266 en 0,469 voor respectievelijk teriflunomide en ublituximab (p=0,484). Binnen ULTIMATE II was dit voor teriflunomide 0,275 en voor ublituximab 0,521 (p=0,0171).
Voor de veranderingen in invaliditeit werden de gegevens van ULTIMATE I en II gepoold. In beide armen van de studies was sprake van een klein percentage patiënten met invaliditeitsprogressie. Daarbij werd geen significant verschil gevonden tussen de twee vergeleken middelen. Wel werd een verschil gevonden in het percentage patiënten dat een invaliditeitsverbetering tijdens behandeling. Na 96 weken behandeling met ublituximab had namelijk 12,0% een 12-weeks bevestigde verbetering laten zien, vergeleken met 6,0% bij teriflunomide. De hazardratio voor deze verbetering was 2,16 (95%-BI: 1,41-3,32) in het voordeel van ublituximab.
Over het algemeen werd ublituximab goed verdragen en kwamen geen onverwachte bijwerkingen aan het licht. In beide groepen werd door circa 88% van de patiënten een bijwerking gerapporteerd. Met ublituximab waren de meest voorkomende bijwerkingen infusiegerelateerde reacties (48%). Deze waren veelal mild en kwamen vooral voor bij de eerste infusie. Andere vaker gerapporteerde bijwerkingen waren hoofdpijn (30%) en nasofaryngitis (18%). Ernstige bijwerkingen kwamen voor bij 6,2% van de patiënten die teriflunomide kregen en bij 9,5% van ublituximab-behandelde patiënten. De meest voorkomende ernstige bijwerkingen waren infecties en infestaties (teriflunomide 2,6% en ublituximab 4,0%) en neurologische bijwerkingen (teriflunomide 1,3% en ublituximab 0,9%). Er werd in de studie geen progressieve multifocale leuko-encefalopathie (PML) gerapporteerd.
CONCLUSIE
In de fase III ULTIMATE I en II-studies behaalde ublituximab het primaire eindpunt met een significant betere relapsfrequentie in vergelijking met teriflunomide. Daarnaast bereikten meer patiënten NEDA en een verbetering van de invaliditeit. Behandeling met ublituximab werd goed verdragen zonder onverwachte bijwerkingen.
Referentie
Steinman L, Fox E, Hartung HP, et al. Phase 3 results of the ULTIMATE I & II global studies: ublituximab versus teriflunomide in relapsing multiple sclerosis. Gepresenteerd tijdens ECTRIMS 2021; abstract 117.
Bron foto Steinman: pnas.org