
Hersenconnectiviteit bij de ziekte van Parkinson (PD) komt voort uit PD-gerelateerde epicentra in de hersenstam en dit valt samen met de anatomische verdeling van het eiwit α-synucleïne in post-mortem histopathologie. De genenset die het meest verband houdt met patronen van PD-gerelateerde pathologie is voornamelijk betrokken bij cellulaire componenten van de microtubili. Hierover vertelde Silvia Basaia (IRCCS San Raffaele Scientific Institute, Milaan, Italië) meer tijdens het AAN-congres.
Op grond van aanwezigheid van het verkeerd gevouwen pathologische eiwit α-synucleïne bij PD, wordt verondersteld dat het pathologische proces van de ziekte op een stereotiepe manier langs specifieke hersensystemen verloopt, van het ene vatbare hersengebied naar het volgende. In recente in vivo neuroimaging-studies werd aangetoond dat de afzetting en aggregatie van deze verkeerd gevouwen eiwitten bij neurodegeneratieve ziekten, zoals bij de ziekte van Alzheimer en PD, niet willekeurig worden verdeeld, maar connectiviteitsnetwerken volgen. In deze studie is een nieuwe technologie toegepast op basis van analyse van stapsgewijze functionele connectiviteit (SFC). Deze methode maakt het in kaart brengen van verbindingspatronen van ‘kiemgebieden’ in de hersenen mogelijk en houdt rekening met directe en indirecte verbindingsroutes (zie Figuur 1).
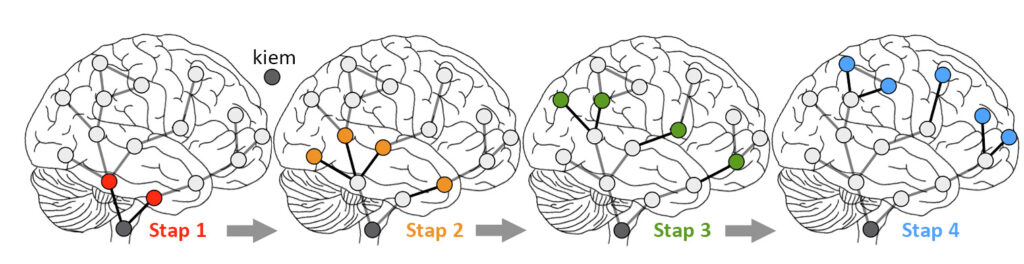
Op deze manier werd inzichtelijk gemaakt hoe PD de functionele organisatie van hersennetwerken kan veranderen en hoe pathologie zich over dergelijke netwerken kan verspreiden.
Bij 146 geïncludeerde PD-patiënten werden op baseline klinisch-cognitieve evaluaties en functionele MRI in rusttoestand (rs-fMRI) uitgevoerd . Op basis van demografie, motorische symptomen, cognitieve en gedragstesten en andere niet-motorische manifestaties werden 86 patiënten geclassificeerd met “milde” PD en 60 met “matige tot ernstige” PD. Tevens werden 60 op leeftijd en geslacht afgestemde gezonde controles geïncludeerd die hetzelfde onderzoeksprotocol ondergingen. Om de functionele verbindingssteigers afkomstig van epicentra van PD-gerelateerde pathologie in de hersenstam te karakteriseren, werd SFC-analyse uitgevoerd met neuroimaging. Vervolgens is de Allen Human Brain Atlas gebruikt om de ruimtelijke kruising van de waargenomen SFC-patronen met genetische transcriptieprofielen te onderzoeken.
De resultaten bevestigden dat hersenconnectiviteit afkomstig is van epicentra in de hersenstam met PD-gerelateerde pathologie en dat dit grotendeels samenvalt met de anatomische verdeling van de histopathologie van α-synucleïne uit post-mortemgegevens. Ook werd ontdekt dat de genenset die het meest gerelateerd is aan corticale verspreidingspatronen van PD-gerelateerde pathologie voornamelijk betrokken is bij cellulaire componenten van microtubuli.
In deze studie werden grootschalige in vivo verspreidingstrajecten van α-synucleïne-pathologie gekarakteriseerd en patronen van functionele connectiviteitsverstoring geïdentificeerd bij PD-patiënten in verschillende stadia van de ziekte. De resultaten hebben de genetische onderbouwing van PD-pathologie bevestigd en benadrukken hun bijdrage aan een focale neuronale kwetsbaarheid voor progressie van PD. Verder banen de studieresultaten de weg voor een betere beschrijving van de complexiteit van de hersennetwerken en de mechanismen die ten grondslag liggen aan de kwetsbaarheid voor PD-pathologie, waardoor vroegtijdige diagnostiek en toekomstige nieuwe therapeutische strategieën mogelijk worden.
Referentie
Basaia S, Agosta F, Diez I, et al. Neurogenetic Traits Outline Vulnerability to Cortical Disruption in Parkinson’s Disease. Neuroimage Clin 2022;33:102941. Gepresenteerd tijdens AAN 2022; S1-02.